Salud
Estados Unidos aprobó por primera vez la píldora para la depresión posparto
sábado 5 agosto, 2023
La Administración de Alimentos y Medicamentos (FDA) de Estados Unidos aprobó por primera vez una píldora para el tratamiento de la depresión posparto, condición que se cree que afecta cada año en ese país a cerca de medio millón de mujeres.
El fármaco antidepresivo, llamado zuranolona, es “el primer medicamento oral indicado para tratar la depresión posparto (DPP)”, informó la FDA en un comunicado.
“Hasta ahora, el tratamiento para DPP solo estaba disponible como una inyección intravenosa aplicada por un profesional sanitario en algunos centros de salud”, agrega el texto.
La doctora Asima Ahmad, directora médica en el centro de salud Carrot Fertility -en Menlo Park, California- dijo que alrededor de “una de cada ocho mujeres experimentan síntomas de DPP tras un alumbramiento reciente y, entre las que informan síntomas, un 75% no recibe tratamiento”.
“En momentos en que estamos viendo el aumento de las tasas de mortalidad materna e importantes disparidades raciales en los resultados maternos, necesitamos enfocarnos en soluciones y eso incluye abordar la depresión posparto”, añadió la experta.
La píldora, diseñada específicamente para la enfermedad, ha mostrado que actúa más rápido que otros antidepresivos y está pensada para que sea tomada en un corto periodo de dos semanas.
Los ensayos del fármaco demostraron efectos secundarios menos severos que los de otros antidepresivos usados actualmente, los cuales pueden conducir a súbitas pérdidas de conciencia, aumento de peso o disfunciones sexuales, indicó Ahmad.
La jefe de psiquiatría del Centro de Evaluación e Investigación de Medicamentos de la FDA, Tiffany Farchione, explicó que la DPP es una “una seria y potencial condición de riesgo vital en la que las mujeres experimentan tristeza, culpa, sentimiento de falta de valor e incluso -en casos severos- pensamientos de hacerse daño a sí mismas o al bebé”.
La píldora, desarrollada por Sage Therapeutics, será comercializada bajo el nombre de Zurzuvae y su precio aún no ha sido anunciado al público.
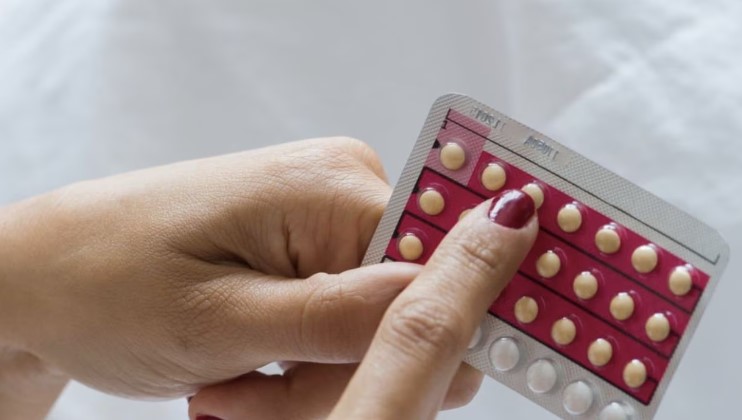
Opill estará disponible en farmacias, comercios y supermercados, así como en línea, anunció la Administración estadounidense de Medicamentos y Alimentos de Estados Unidos (FDA).
Esta decisión debería “reducir las barreras de acceso” a este método anticonceptivo, estima la FDA en un comunicado.
“Cuando se utilizan según las indicaciones, los anticonceptivos orales diarios son seguros y se espera que sean más eficaces que los métodos anticonceptivos sin receta disponibles en la actualidad para prevenir embarazos no deseados”, declaró Patrizia Cavazzoni, directiva de la FDA.
Las píldoras basadas en hormonas han sido la forma más común de control de la natalidad en Estados Unidos, utilizadas por decenas de millones de mujeres desde la década de 1960. Hasta ahora, todas se vendían bajo receta.
Las asociaciones de médicos y promotoras de la salud femenina han hecho campaña a favor de un mayor acceso, señalando que aproximadamente el 45 % de los 6 millones anuales de embarazos son involuntarios.
Las adolescentes y las niñas, las mujeres de color y las de bajos ingresos denuncian los mayores obstáculos para obtener recetas y pagar las píldoras. Esos obstáculos son, entre otros, pagar la visita médica, obtener permiso de salida del trabajo y conseguir niñera.
“Esto es una verdadera transformación en el acceso a la anticoncepción”, dijo Kelly Blanchard, presidenta de Ibis Reproductive Health, una ONG que apoyó la nueva norma. “Esperamos que esto ayude a la gente a superar esas barreras”.
Perrigo, con sede en Irlanda, no anunció el precio. Los medicamentos de venta libre suelen ser mucho más baratos que los de venta bajo receta, pero los seguros no los cubren.
*Con información de AFP, AP y Europa Press.
Destacados